التآكل
ما هو التآكل
بشكل عام ، يمكن تعريف التآكل بأنه "تعرض مادة ما للتفاعل الكيميائي أو الكهروكيميائي أو المعدني بين المادة والبيئة بحيث لا يمكنها أداء وظيفتها الطبيعية". واردة ، يحدث هذا في شخصية بطيئة ولكنها مستمرة. في بعض الحالات ، تحدث تأثيرات التآكل فقط عن طريق تلوين المعدن على شكل غشاء لاصق رقيق ويمكن أن يكون له تأثير تثبيط تآكل لاحق. في معظم الحالات ، يكون للمنتج المتآكل شخصية سطح كبيرة ومسامية وغير محمية.
التآكل ، الذي يعد من أهم مشاكل الصناعة ، يتسبب في أضرار بمليارات الدولارات في الصناعة كل عام. على الرغم من وجود قدر كبير من المعرفة حول هذا الموضوع ، فإن التآكل مشكلة معقدة ولا يزال هناك الكثير لنتعلمه على الرغم من البحث المكثف. في بعض الحالات ، مثل التأثيرات الكيميائية المباشرة ، يمكن أن يصبح التآكل أمرًا حتميًا للغاية.
السبب الرئيسي للتآكل هو أن المعادن غير مستقرة في أشكالها النقية النقية. تميل المعادن دائمًا إلى العودة إلى أشكالها في الطبيعة.
المبادئ الكهروكيميائية
التآكل هو عملية كهروكيميائية ناجمة عن تحويل بعض أو كل المعدن من المعدن إلى الأيوني. يتطلب التآكل تيارًا بين سطح معين من المعدن وجانب المنحل بالكهرباء. المنحل بالكهرباء هو أي محلول يحتوي على أيونات. على سبيل المثال ، يحتوي الماء النقي على كميات متساوية من أيونات الهيدروجين الموجبة الشحنة (H +) وأيونات الهيدروكسيل (OH-) سالبة الشحنة.
في هذه الحالة ، يمكن أن يكون المحلول الكهربائي عبارة عن ماء عادي أو محلول ملحي أو حمض أو أي محاليل قلوية مكثفة. لإكمال التيار الكهربائي ، هناك دائمًا حاجة إلى قطبين ، أحدهما أنود والآخر كاثود ، ويجب توصيلهما. يمكن أن تكون الأقطاب المعدنية معدنين مختلفين أو منطقتين مختلفتين على نفس المعدن. يتم تحقيق الوصلة بين الأنود والكاثود من خلال جسر معدني وعمومًا من خلال اتصال بسيط. لكي يحدث التيار الكهربائي ، يجب أن يكون هناك فرق محتمل بين الأقطاب الكهربائية.
|
|
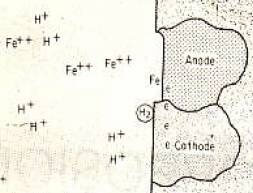
إذا وضعنا قطعة بسيطة من الحديد في محلول حمض الهيدروكلوريك ، فإننا نلاحظ تكوين غاز الهيدروجين الكثيف. هناك العديد من مناطق الأنود والكاثود الناعمة على السطح المعدني الناجم عن بقايا تسمى الشوائب البسيطة ، والمخالفات السطحية ، وحالات الإجهاد المختلفة ، والمناطق واتجاهات الخلية المختلفة أو التغيرات في الظروف البيئية. يتم عرض هذه الشروط بشكل تخطيطي في الشكل 1.
على جانب الأنود ، تظهر ذرات حديد مشحونة بشكل إيجابي من السطح وتختلط في المحلول كأيونات ذات شحنة موجبة ، بينما تبقى تلك الموجودة في شكل إلكترونات سالبة الشحنة في المعدن. تلتقي الإلكترونات وتحييد أيونات الهيدروجين الموجبة الشحنة التي تأتي إلى السطح من خلال محلول الإلكتروليت على جانب الكاثود. تصبح الأيونات الموجبة التي فقدت شحنتها ذراتًا محايدة وتتفاعل مع غاز الهيدروجين.
وهكذا ، مع استمرار العملية ، تحدث أكسدة الحديد وتآكله على جانب الأنود وإخراج الهيدروجين على جانب الكاثود. تتناسب نسبة المعدن المذاب بشكل مباشر مع عدد الإلكترونات التي تتشكل اعتمادًا على قوة وإمكانات المعدن. |
|
الشكل (1): الأيونات في الأنود في تكوين بطارية الخلية الإقليمية الصغيرة والتمثيل التخطيطي لتكوين الهيدروجين في الكاثود
|
|
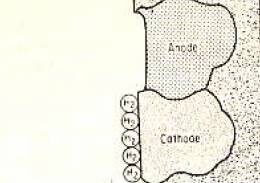
استقطاب الكاثود الإقليمي بطبقة من الهيدروجين |
من أجل استمرار التآكل ، من الضروري إزالة طبقات التآكل من الأنود والكاثود. في بعض الحالات ، يكون تكوين غاز الهيدروجين عند الكاثود بطيئًا للغاية ويؤدي تكوين طبقة الهيدروجين على سطح المعدن إلى إبطاء التفاعل.
تسمى هذه الحالة الموضحة في الشكل 2 الاستقطاب النقطي. ومع ذلك ، يتفاعل مستوى الأكسجين المذاب في محلول الإلكتروليت مع الهيدروجين ويصل إلى المستوى لتكوين الماء ، مما يتسبب في التآكل.
تعتمد إزالة هذه الطبقة للحديد والماء على كثافة الأكسجين الذائبة الفعالة الملتصقة بالكاثود في الماء.
تعتمد هذه الكثافة الفعالة على التهوية وكمية الحركة ودرجة الحرارة وكمية الملح المذاب وعوامل أخرى على التوالي. غالبًا ما تتفاعل منتجات عمليات الأنود والكاثود مع بعضها البعض في المحلول وتتسبب في تكوين العديد من منتجات التآكل المعروفة والمرئية. |
|
|
غالبًا ما تتفاعل منتجات عمليات الأنود والكاثود مع بعضها البعض في المحلول وتتسبب في تكوين العديد من منتجات التآكل المعروفة والمرئية.
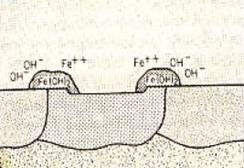
على سبيل المثال ، يواجهون حركة أيونات الهيدروكسيل في الماء من التفاعلات المهبطية للحديد إلى الأنود من خلال المنحل بالكهرباء والحركة المعاكسة لأيونات الحديد. تشكل هذه الأيونات هيدروكسيد الحديد حيث تتحلل في الشكل 3.
يتفاعل هذا بعد ذلك مع الأكسجين الموجود في المحلول لتكوين هيدروكسيد الحديديك ، والذي سيترسب ويشكل طبقة الصدأ من الحديد. اعتمادًا على القلوية ، وكمية الأكسجين وتحريك المحلول ، يتشكل هذا الصدأ على السطح بعيدًا عن سطح الحديد أو بطريقة تؤثر على عملية التآكل وتزيدها. |
|
الشكل (3): تكوين هيدروكسيد الحديد في صدأ الحديد |
العوامل المؤثرة على التآكل
|
أحد أهم العوامل التي تؤثر على التآكل هو الاختلاف الكهربائي المحتمل الناتج عن معادن مختلفة عند توصيلها معًا أو إدخالها في محلول إلكتروليت. ترجع هذه الإمكانات إلى الطبيعة الكيميائية للمناطق الغريبة والقطية. يتم إعطاء قيم المؤشر أن بعض المعادن يمكن أن تكون أنودية عند مقارنتها مع الهيدروجين في الجدول القياسي "سلسلة الطاقة الكهربائية الحركة" في الجدول 1. من خلال أخذ قيمة خلية الهيدروجين القياسية إلى الصفر ، يتم رؤية القيم الكهربية للمعادن بشكل نسبي. يتم إعطاء هذه القيم بترتيب تنازلي. تظهر المعادن الأكثر نشاطًا ميلًا أقوى للذوبان في المحلول من المعادن الموجودة في أعلى القائمة ، في أسفل القائمة. تحتوي سلسلة Electro-Motion على معادن فقط في الظروف التي يتم فيها تحديد السلسلة. يتم تضمين المعادن التي تعمل في محاليل إلكتروليت خاصة تحتوي على محلول ملحي. في ظل ظروف التشغيل الحقيقية ، قد يختلف سلوكهم في حلول المنحل بالكهرباء الأخرى. بدلاً من سلسلة Electro-Motion ، يتم استخدام "سلسلة كلفانية" مماثلة في تجربة على تكوين المعادن في مجموعة واسعة من الظروف البيئية. هنا ، "كلفاني" هو المعنى الذي ينتج ويستخدم التيار الكهربائي. يقدم الجدول 2 أمثلة لبعض المعادن والسبائك تتحرك بسرعة عالية في مياه البحر. المواد الموجودة في أعلى هذه القائمة هي أنودية وتخضع للتآكل ، في حين أن المواد الموجودة في أسفل القائمة هي كاثودية ومحمية بشكل كلفاني. يرتبط فرق الجهد الكهربائي بين المعدنين بالفرق بينهما في السلسلة الجلفانية. يؤدي الجمع بين المواد المتقاربة في القائمة الجلفانية إلى حدوث التآكل ببطء أكثر من المواد البعيدة.
عملية الشطف أو الخلط لها تأثير على زيادة معدل التآكل لأنها تلامس محلول التآكل الطازج مع المعدن. |
|
|
الجدول - 1 |
سلسلة قوة الحركة الكهربائية |
|||
|
تفاعل القطب |
الجهد الكهربائي القياسي , E º |
تفاعل القطب |
الجهد الكهربائي القياسي , E º |
|
|
K = K+ + e- |
-2,922 |
Co = Co++ + 2e- |
-0,277 |
|
|
Ca = Ca++ + 2e- |
-2,87 |
Ni = Ni++ + 2e- |
-0,250 |
|
|
Na = Na+ + e- |
-2,712 |
Sn = Sn++ + 2e- |
-0,136 |
|
|
Mg = Mg++ + 2e- |
-2,34 |
Pb = Pb++ + 2e- |
-0,126 |
|
|
Be = Be++ + 2e- |
-1,70 |
1/2H2 = H+ + e- |
-0,000 |
|
|
Al = Al3+ + 3e- |
-1,67 |
Cu = Cu++ + 2e- |
0,345 |
|
|
Mn = Mn++ + 2e- |
-1,05 |
Cu = Cu+ + e- |
0,522 |
|
|
Zn = Zn++ + 2e- |
-0,762 |
Ag = Ag+ + e- |
0,800 |
|
|
Cr = Cr3+ + 3e- |
-0,71 |
Pd = Pd++ + 2e- |
0,83 |
|
|
Ga = Ga3+ + 3e- |
-0,52 |
Hg = Hg++ + 2e- |
0,854 |
|
|
Fe = Fe++ + 2e- |
-0,440 |
Pt = Pt++ + 2e- |
1,2 |
|
|
Cd = Cd++ + 2e- |
-0,402 |
Au = Au3+ + 3e- |
1,42 |
|
|
In = In3+ + 3e- |
|
Au = Au+ + e- |
1,68 |
|
أنواع محددة من التآكل
يستخدم تعريف التآكل النوعي بشكل عام لأنواع محددة من التآكل في التطبيقات الصناعية. عندما يصدأ سطح المعدن بالكامل بنفس المعدل ، يسمى هذا التآكل المنتظم. هذا النوع من التآكل ليس شائعًا جدًا في المعادن لأنه نادرًا ما توجد المعادن في حالة متجانسة.
تآكل التنوي (التنقر)
|
شوهدت الادراج في قطاعات غير متجانسة من المعادن بسبب المناطق المفتوحة التي لا يمكن رؤيتها للعيون. هذه الأقسام غير المتجانسة تخلق اختلافات محتملة في المعدن وتسبب تشكيل ثقوب عازلة للغاية. بدءًا من منطقة صغيرة ناجمة عن مخالفات صغيرة على السطح لا يمكن رؤيتها ، تنمو الحفرة بسرعة وتتخذ شكل ثقوب كبيرة. بعد هذه العطلة ، تتسع الحفرة تحت السطح المعدني. ثم تنهار القشرة المعدنية المشكلة وتظهر حفرة ناتجة عن التآكل على السطح. يوضح الشكل 4 تآكل التنوي الذي يحدث على سطح معدني مغمور في مياه البحر. تؤدي فتحة صغيرة في الطبقة الواقية إلى بدء تآكل التنوي. على سبيل المثال ، عندما يتشقق طلاء الكروم (إن لم يكن) على مصدات السيارات القديمة ، يبدأ تآكل التنوي. |
|
تآكل الأبقار
|
كما هو موضح في الشكل 5 ، يتكون من الفقاعات وانهيار التجاويف في السائل. مثل الأحمال المتكررة المطبقة على السطح ، تتسبب حركة الاهتزاز بين السطح والسائل في حدوث ضغوط كبيرة عندما تتشكل هذه الفقاعات بانتظام وتنهار أو تنفجر. تؤدي هذه الانخفاضات أو الانفجارات تدريجيًا إلى تكوين نبضات عالية الضغط تتسبب في كسر الجسيمات على السطح وفي النهاية حفر وحواف. تتمتع الفولاذ المقاوم للصدأ بمقاومة جيدة للتآكل. ومع ذلك ، فإن مقاومة مسبوكات الحديد الزهر والبرونز والصلب لهذا النوع من التآكل منخفضة. |
|
تآكل ديسمبر (الكراك)
|
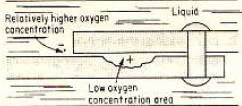
الترابط بين المعدنين المعرضين لبيئة التآكل هو تكوين التآكل في مناطق الاحتفاظ. نحن نعلم أن الفجوات الصغيرة في المفاصل عادة ما تحتوي على محلول أكثر وأن هذا التجفيف بالرطوبة أو المحلول يستغرق وقتًا أطول من المناطق الأخرى. وبالمثل ، تتسبب هذه الفواصل في التآكل في ظروف التشغيل العادية ، حتى في السائل أو المحلول. كما يتبين من الشكل 6 ، يتم إنشاء الظروف المحتملة للتآكل بسبب اختلاف محتمل في تركيز الأكسجين.
يمكن الوصول بسهولة إلى الأكسجين من خارج التقاطع ، والذي سيكون بمثابة طرف كاثودي في الدائرة. الجزء الموجود داخل نقطة التوصيل سيكون بمثابة أنود. بسبب الانخفاض التدريجي في كثافة الأكسجين في الجزء بين نقطة التوصيل ، سيزداد فرق الجهد الكهربائي.
إذا استمر هذا الوضع ، فسيبدأ التآكل بمرور الوقت عند التقاطع بسبب انخفاض كثافة الأكسجين. يبدأ التآكل دائمًا حيث يكون تركيز الأكسجين منخفضًا. يمكن أن تؤدي الفجوات والشقوق أيضًا إلى اختلافات في كثافة أيونات المعادن.
على سبيل المثال ، قد تكون كثافة أيون المعادن في النطاق أعلى من الخارج. كما يتضح من الشكل 7 ، يمكن أن يسبب هذا تآكلًا في المنطقة حيث تكون كثافة أيون المعادن منخفضة ، أي في الجزء الخارجي من منطقة الوصلة. الطريقة الأكثر فعالية لمنع هذا التآكل هي عمل تصميم يزيل الثغرات في مرحلة التصميم تمامًا ، أو لملء جميع الفجوات والمفاصل التي يعتقد أنها تسبب مشاكل مع معدن الحشو. |
|
ارتداء التآكل
|
هو نوع عام من تآكل السطح الناجم عن الاهتزاز الذي يحدث بسبب الارتطام أو الصدمة أو الاحتكاك على أسطح التوصيل العالية ، أسطح التحميل العالية. يحدث هذا التآكل في الأجزاء التي يتم الضغط عليها أو تثبيتها بإحكام وتعمل تحت أحمال متغيرة لحظية. يتسبب التآكل الناتج عن التآكل في إتلاف التروس ، ويضعف أبعادها ويقلل من قوة التعب.
في حالة فرك معدنين ، سوف تتسبب القوى المطبقة في لحام الجسيمات الصغيرة على السطح. مع الحركة المستمرة ، تتحرك هذه الجسيمات الصغيرة ، تخدش السطح وتتفاعل مع الغلاف الجوي لتكوين جسيمات على شكل غبار عند التقاطع. في الشكل 8 ، يمكنك رؤية تآكل التآكل لعمود في مضخة ضخ الزيت أثناء اختبار التعب. هناك العديد من الطرق لمنع تآكل التآكل.
الطريقة الأكثر ملاءمة هي التخلص من الاهتزاز الناجم عن المشبك الضيق أو تركيب الجزء بطريقة لا تسبب المزيد من الاهتزاز. بعض الطرق الأخرى هي ؛ من أجل زيادة صلابة أسطح الانضمام ، لوضع قطعة مطاطية على المفاصل التي تمتص الحركة ، للتشحيم في بيئة جافة ، لإغلاق السطح بالكامل بمواد مثل حشو المطاط من أجل فصل المواد عن الغلاف الجوي ، إلخ. "الدكتور |
|
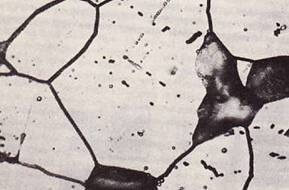
التآكل بين الحبيبات
إنه تآكل يحدث عندما يكون للسبائك (أو الخلايا) فرق محتمل في السبائك. عادة ما يحدث هذا التآكل مع تكوين مرحلة أخرى تترسب في محلول صلب. بما أن تكوين الرواسب عند حدود الحبوب أسرع بكثير ، فإن المناطق حول حدود الحبوب تمتلئ بالعنصر المذاب وتختفي حدود الخلية إلى حد ما. (انظر الشكل -9) عند عرضه سطحيًا ، قد لا يكون الضرر مرئيًا بالكامل وفي معظم الحالات سيكون هناك انخفاض ملحوظ في الخصائص الميكانيكية.
الإجهاد (أو الإجهاد) التآكل
إنه نوع من التآكل يحدث في بعض الظروف البيئية بسبب الضغوط الخارجية للمعادن أو الضغوط الداخلية المتبقية من الدرفلة الباردة. قد يكون التكسير الناتج في شكل حبيبات بين حبيبية أو فوق حبيبات أو مزيج من كليهما. يعتمد حجم الضغط الذي يسبب التشقق على البيئة التي تسبب التآكل وهيكل المعدن الأساسي.
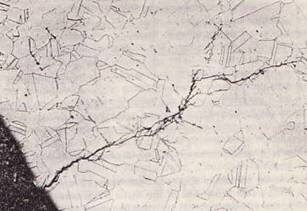
تآكل التوتر هو نوع مهم جدا من التآكل لأنه يمكن أن يحدث في العديد من المعادن. على الرغم من أن جميع المعادن تقريبًا تتأثر من حيث تآكل الإجهاد ، إلا أن الحالة التي تخلق تشققات أو كسور لمعدن واحد قد لا تؤثر بشكل طبيعي على المعدن الآخر بنفس الطريقة. لذلك من الصعب التنبؤ بمكان حدوثها بالضبط. النيتروجين الموجود في الفولاذ يجعل الفولاذ عرضة للتشقق من التآكل في بعض محاليل النترات.
الفولاذ الذي يحتوي على الألومنيوم أكثر مقاومة للتشقق الناتج عن تآكل الإجهاد ، حيث يتفاعل الألومنيوم مع النيتروجين لتشكيل نترات الألومنيوم. تكون بعض أنواع الفولاذ المقاوم للصدأ أكثر عرضة للتآكل الناتج عن تآكل الإجهاد في البيئات المحتوية على الكلوريت مثل كلوريت الصوديوم ، مثل كلوريت الكالسيوم. مشكلة صدع تآكل الإجهاد هي مشكلة تحدث عند استخدام الفولاذ الأوستنيتي في البيئات المحتوية على الكلوريت. يوضح الشكل - 10 تشقق تآكل التوتر لصلب من الفولاذ المقاوم للصدأ الأوستنيتي ذي الجودة 304.
الفولاذ المقاوم للصدأ من الحديد أكثر مقاومة لمشاكل تآكل الإجهاد من الفولاذ المقاوم للصدأ الأوستنيتي أو المارتينسي. يعمل تآكل الإجهاد على تقليل الخصائص الميكانيكية للمادة بشكل ملحوظ. يمكن ملاحظة تأثير بعض أنواع التآكل على الخواص الميكانيكية للمادة في الجدول 3.
|
جدول 3: تأثير بعض أنواع التآكل على الخواص الميكانيكية للمادة |
|||||
|
نوع التآكل |
فقدان الوزن (٪) |
عمق الاختراق (٪) |
الخسائر في العقارات (٪) |
||
|
كسر موك. |
يتدفق موك. |
استطالة |
|||
|
تمهيد |
1 |
1 |
1 |
1 |
1 |
|
التنوي |
0,7 |
5 |
7 |
5 |
15 |
|
بين الحبيبات |
0,2 |
15 |
25 |
20 |
80 |
|
الجهد |
0,1 |
100 |
100 |
100 |
100 |
|
|
|
تآكل كلفاني
نتيجة لاتصال اثنين من المعادن مع بعضها البعض في بيئة عرضة لتشكيل التآكل ، يتم تشكيلها في الواجهة حيث تتلامس.
 العربية
العربية